 BTC/HKD+0.73%
BTC/HKD+0.73% ETH/HKD+0.23%
ETH/HKD+0.23% LTC/HKD+1.1%
LTC/HKD+1.1% ADA/HKD-0.58%
ADA/HKD-0.58% SOL/HKD+1.97%
SOL/HKD+1.97% XRP/HKD-0.3%
XRP/HKD-0.3%一、寶劍鋒從磨礪出,技術突破引領新發展
小核酸藥物發展過程曲折,歷經浮沉
小核酸藥物作為諾貝爾獎級理論的臨床實踐,堪稱人類疾病治療領域的革命性技術進步,但其發展并非一帆風順。我們認為,小核酸藥物的發展歷程可以概括為發現期、探索期、低谷期、發展期。發現期:1978年哈佛大學科學家Zamecnik等人首次提出反義核酸概念。1998年,FDA批準了全球首款ASO藥物Vitravene上市,用于治療艾滋病人的眼部CMV病感染。同年,AndrewFire和CraigMello在線蟲中首次揭示了RNAi現象,兩人也因此榮獲2006年諾貝爾生理學與醫學獎。2001年Tuschl等首次利用體外合成的siRNA實現了哺乳動物細胞中的基因表達調控,標志著RNAi擁有了從研究走向制藥的潛力,同年,RNAi技術被Science雜志評為2001年的十大科學進展之一。探索期:2004年,OPKO公司用于濕性老年性黃斑變性病的第一個siRNA藥物Bevasiranib進入臨床試驗,之后大型制藥企業羅氏、默克、輝瑞、賽諾菲、雅培等紛紛進入這一領域,投入了數十億美元資金,小核酸藥物研發迎來快速探索期。低谷期:然而,由于siRNA在體內不穩定、以及潛在的免疫原性等問題無法解決,小核酸藥物的發展一度在2009年至2013年陷入低谷期,資本的離場讓小核酸藥物研發陷入寒冬。發展期:不過,以Alnylam為代表的創新生物技術企業一直在潛心探索新技術,在2013年后,以GalNAc綴合技術和增強的穩定化學修飾技術為代表的新技術出現極大地促進和推動了小核酸制藥的快速復蘇。2016年,SareptaTherapeutics和Ionis研發的2款ASO藥物先后被FDA批準上市。2018年,Ionis和Alnylam的兩款治療由hATTR引起的多發性神經病的孤兒藥陸續獲批,其中Patisiran成為全球第一個獲批的siRNA類藥物。2020年,黑石宣布投資20億美元于Alnylam公司研發siRNA藥物。目前,全球有超過20余款siRNA藥物,50余款ASO藥物處于臨床研究階段,治療領域覆蓋中樞神經系統、心血管、抗感染和抗腫瘤等。

關鍵技術突破,小核酸產業化瓶頸問題終將解決
小核酸藥物開發過程中最大的難題是避免快速被降解并精準進入靶向細胞發揮治療功能。在藥物設計與合成方面,目前國內外均有相當成熟的技術,隨著基因測序技術的發展,測序成本降低,為小核酸藥物產業化提供了可能。在小核酸藥物的開發過程中最大的難點是向病人注射小核酸藥物后,藥物如何在體內存留足夠長的時間、并精準進入靶向細胞發揮治療功能,同時最大程度的避免誤傷正常細胞。
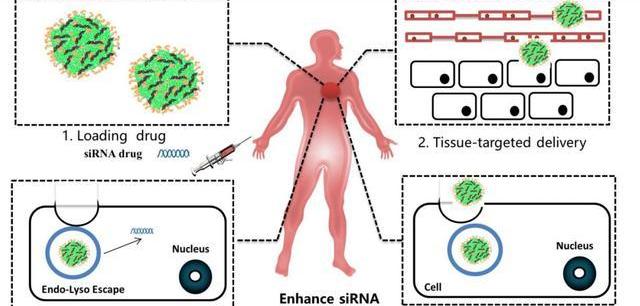
化學修飾與遞送系統的技術突破推動小核酸藥物產業化進程。小核酸在血液中不穩定極易被降解,同時可能會觸發人體免疫應答反應,并且不易穿過細胞膜進入細胞。因此,小核酸藥物進入人體發揮治療作用需要克服幾個關鍵問題:如何避免入血后被快速清除并延長半衰期;如何避免被核酸酶降解;如何提高組織滲透性,靶向目標細胞并提高細胞攝取效率;如何有效地實現內涵體逃逸。隨著技術突破,部分難題目前得到較好的解決辦法,其中化學修飾可以避免核酸藥物被核酸酶降解并延長半衰期,高效安全的遞送系統可以使核酸藥物精準的靶向目標細胞并提高細胞攝取效率,使核酸藥物發揮治療功能。
1.化學修飾技術增強小核酸藥物在血液中的穩定性并降低免疫原性
核酸在體內不穩定,進入血液之后極易被核酸酶降解,且容易通過腎臟清除,半衰期短,同時外源的核酸分子具有免疫原性,容易引起人體的免疫反應。化學修飾技術可以較好地解決上述問題,目前常用的核苷酸化學修飾技術包括磷酸骨架、核糖、核糖五元環改造、堿基、核苷酸練末端改造。常見核酸藥物化學修飾技術如下圖所示。
2.遞送系統可提升小核酸藥物胞吞效率
小核酸藥物從進入人體到發揮藥物作用主要經歷逃避核酸酶清除、靶向組織細胞、實現胞吞、內涵體逃逸。盡管化學修飾能夠解決穩定性和免疫原性的問題,但如果不能進入細胞實現胞吞,小核酸藥物依然不能發揮藥物作用。這一瓶頸問題一度難以解決,阻滯小核酸藥物產業化進程。隨著技術的不斷進步,遞送系統成為解決這一瓶頸問題的關鍵辦法。目前應用于小核酸藥物研發的遞送系統在尺寸、形狀、結構、化學性質和作用機制上都不是完全相同的,這種多樣性反應了研究者們對大部分遞送過程背后機制的理解仍在不斷發展,展現出了小核酸遞送領域創新的巨大空間。我們主要從材料設計和遞送方法方面總結具有應用前景的小核酸遞送系統。
四川省出臺中醫藥創新發展實施意見 利用區塊鏈等為中醫藥行業提供數據支撐:四川省出臺關于促進中醫藥傳承創新發展的實施意見。意見指出,提升中醫藥信息化支撐能力。充分利用中醫藥大數據資源,推進云計算、物聯網、人工智能及區塊鏈技術應用,為全省中醫藥行業發展提供數據支撐。(四川日報)[2020/4/12]
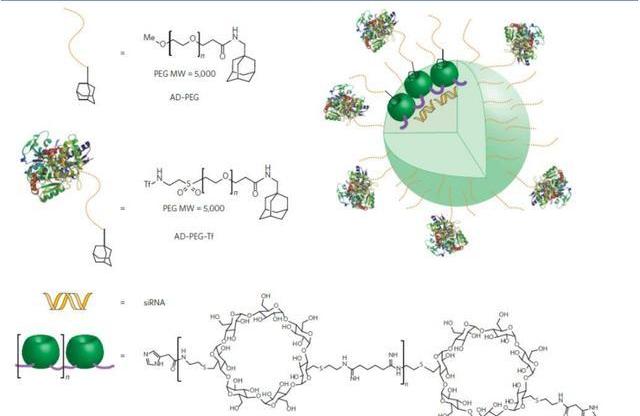
2.1環糊精納米聚合物
環糊精聚合物為陽離子低聚物,是帶二胺的環糊精單體和二甲基琥珀酰亞胺酯通過聚合反應合成產生的帶有脒官能團的低聚物。這些脒基的強堿性使得核酸與CDP在氮/磷比例低至3時就可以進行高效負載。用咪唑官能團封端聚合物末端可以幫助內體逃逸,使得質粒DNA和siRNA的遞送效率提高。目前的研究已經在幾種與治療相關的動物模型中評估了CDP-siRNA遞送系統。在尤文肉瘤的異種移植模型中,siRNA與CDP納米顆粒結合,用以靶向致癌的EWS-FLI1融合基因。這些誘導基因被沉默,并產生了抗增殖效應,并且靜脈內給藥時沒有產生先天性免疫反應。在小鼠皮下腫瘤模型中,靶向的CDP遞送系統顯示出針對核糖核苷酸還原酶亞基2的有效沉默。在食蟹猴中評估遞送系統的臨床可行性,證明其可以耐受的給藥劑量高達27mg/kg。最后,通過監測siRNA介導的RRM2mRNA裂解,顯示出siRNA可沉默人黑色素瘤患者體內的靶基因,顯示出CDP-siRNA遞送系統的臨床潛力。
2.2脂質納米顆粒
脂質體siRNA制劑的活性首次于2016年在非人靈長類體內被證實。自此,許多脂質納米顆粒RNAi藥物已進入臨床試驗,包括針對高膽固醇血癥,轉甲狀腺素蛋白介導的淀粉樣變性和癌癥的治療。在用于siRNA之前,脂質體作為基于DNA的藥物遞送載體被研究數十年,因為它們既能保護包埋的寡核苷酸免受核酸酶降解和腎清除,又能幫助促進細胞攝取和內涵體逃逸。目前,全球的研究團隊已經開發了許多不同的脂質和脂質樣結構和制劑方法,產生了各種各樣的LNP。Patisiran就是依托脂質納米粒的一款小核酸藥物,順利通過臨床Ⅲ期試驗,2018年成為史上第一個被批準上市的siRNA藥物。
2.3綴合物遞送系統
綴合物遞送系統,即通過化學鍵共價連接將小核酸直接連接在具有靶向功能的遞送載體上以實現遞送目的,這種系統是明確的單組分系統,僅使用等摩爾量的遞送材料和小核酸。第一個在體內生效的綴合物遞送系統由綴合于膽固醇的siRNA和其他親脂性分子組成。還有一些綴合物遞送系統將siRNA連接至聚合物,肽,抗體,適體和小分子。全球研發進展處于前沿的CDS主要為DPC和GalNAc綴合物。
動態多聚綴合物
動態多聚綴合物于2007年首次得到報道,是用于響應細胞內環境的siRNA-聚合綴合物遞送系統的研究成果。這些綴合物包含幾個部分,每個部分都在遞送過程中發揮特定作用。siRNA通過可水解的二硫鍵連接到聚合物上;當遞送系統處于血液循環中時,聚合物的活性被PEG側鏈掩蓋;通過受體介導的內吞作用誘導靶細胞攝取;PEG在內涵體的酸性環境中脫落,暴露膜-活性聚合物并觸發內涵體逃逸;二硫鍵在細胞溶膠的還原環境中被切割,從遞送聚合物中釋放siRNA;并且siRNA本身受到化學修飾,以提高穩定性并減少蛋白質效應。
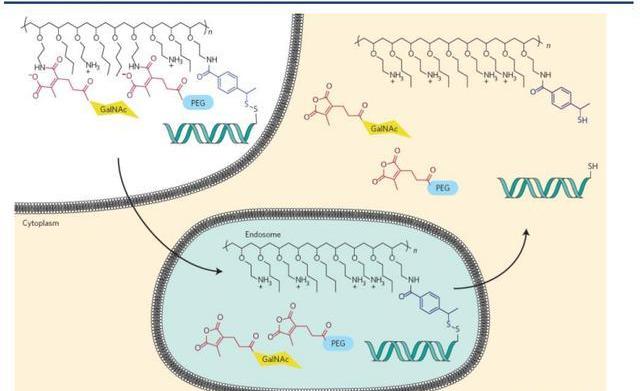
箭頭公司正在開發新一代的DPC。原始PBAVE聚合物通過不受控制的聚合反應合成,導致尺寸和組成的不均勻性。新一代的DPC聚合物采用受控自由基聚合法合成,包括原子轉移自由基聚合和可逆加成—斷裂鏈轉移,生成更優化更合適的均相聚合物。為了減少性,可水解的鍵放在聚合物主鏈和側鏈等不同位置。該公司還報告了通過使用膜活性聚合物和PEG屏蔽劑之間更穩定的鍵,開發了具有更長體內循環的DPCs。據報道,最新一代的DPCs在非人靈長類動物體內使用0.2mg/kg劑量后,可介導沉默99%的肝臟靶基因,其藥效可持續近7周。此外,箭頭公司開創性地發明共注射策略用于治療乙型肝炎,藥物名稱為ARC-520。可惜的是,該藥物因性問題暫停于臨床Ⅱ期。
三觸角乙酰半乳糖胺-siRNA
三觸角乙酰半乳糖胺-siRNA是由化學性質穩定的siRNA與三價靶向配體組成的肝靶向siRNA綴合物。在該遞送系統中,siRNA正義鏈的3'末端通過三元間隔子與三個GalNAc分子連接。
環球印務:公司將推進區塊鏈技術在醫藥溯源等領域的開發和應用:金色財經報道,環球印務(002799.SZ)在2019年報中指出,公司順應國家科技發展戰略,探索“區塊鏈”領域。目前區塊鏈產業發展的政策體系逐步完善,各地政府積極從產業高度定位區塊鏈技術,區塊鏈技術已經上升到國家科技戰略層面。隨著藥品溯源制度的全面深入推進,公司與北京愛斯瑞特合作成立新公司,旨在充分利用雙方股東在專業制造和區塊鏈技術的平臺優勢、資源優勢、技術優勢和經驗優勢,促成區塊鏈技術在醫藥溯源、醫藥物流、消費者安全用藥、醫保控費、供應鏈平臺等領域的開發和應用,共同培育和打造新一代區塊鏈技術產品和服務。[2020/4/11]
Alnylam制藥公司正在研究綴合物ALN-TTRsc,ALN-PCS和ALN-AT3,分別用于治療轉甲狀腺素蛋白淀粉樣變性,高膽固醇血癥和血友病。Alnylam的GalNAc綴合物使用具有20-間距的三聯體GalNAc配體,其以高親和力與ASGPR結合。通過將該綴合物皮下和靜脈內注射相比較,發現皮下注射會使siRNA在肝臟中積累更多,并且沉默靶基因的效果更強因此基于這種綴合物的三種候選藥物給藥途徑均為皮下注射。
ALN-TTRsc用于沉默甲狀腺素運載蛋白,從而治療TTR介導的淀粉樣變性,是Alnylam研發的臨床上最先進的GalNAc綴合物。在非人靈長類動物中,以2.5mg/kg的給藥劑量每日給藥一周后,ALN-TTRsc皮下注射使循環TTR蛋白減少70%,循環TTRmRNA水平伴隨降低。通過每周給予相同劑量的藥物可維持這種TTR表達水平,在停止治療后血清TTR逐漸恢復到給藥前水平。在300mg/kg的給藥劑量下沒有觀察到明顯的細胞因子誘導,補體活化或其他不良反應的跡象,表明這種藥物具有廣泛的治療窗口。已經通過組織學試驗在小鼠中證實預期的治療表型,外周組織中TTR沉積物減少。
其他兩種藥物也正在研究中,其使用相同的GalNAc靶向配體將siRNA遞送至肝臟細胞。通過改變siRNA序列,綴合物已被用于沉默兩種循環蛋白的表達:PCSK9,作用于肝細胞對低密度脂蛋白的攝取;抗凝血酶,其調節凝血酶并在血液凝固中起作用。ALN-PCSsc是一種靶向PCSK9的綴合物,用于治療高膽固醇血癥,在人源化小鼠中對靶基因的沉默效果表現出劑量依賴性,半數最大有效濃度為0.3mg/kg。ALN-AT3靶向抗凝血酶用于治療血友病和罕見出血性疾病。以1.0mg/kg的給藥劑量單次給藥后,ALN-AT3可以使非人靈長類動物的血清AT蛋白水平降低50%,并且每周劑量低至0.5mg/kg使血清AT水平穩定降低75-80%。
目前全球小核酸制藥企業,包括Ionis,Arrowhead,Dicerna,Silence,以及國內小核酸領軍企業瑞博均開發了各自的乙酰半乳糖胺系統。Patisiran據稱將是Alnylam最后一個基于脂質納米粒的siRNA藥物,其余均已轉向乙酰半乳糖胺遞送系統。乙酰半乳糖胺遞送系統最大的意義是展示了配體系統遞送小核酸的巨大潛力。
二、特異性調控基因表達,小核酸藥物堪稱優秀的魔法師
狹義的小核酸是指小干擾RNA,而廣義的小核酸則包括小干擾RNA、反義寡核苷酸、信使RNA、核酸適配體等。與小分子化學藥和抗體藥物不同,小核酸藥物由核苷酸組成。目前全球范圍內,主要的小核酸藥物類別是ASO、siRNA、mRNA和Aptamer。因此在本文中,我們著重對此四類小核酸藥物進行分析。
ASO反義寡核苷酸類藥物
ASO是一種單鏈寡核苷酸分子,單鏈,通常包含15-25個核苷酸。ASO進入細胞后在核糖核酸酶H1的作用下通過堿基互補配對原則與其互補的靶mRNA結合,抑制靶基因的表達。具體作用機制主要包括與靶基因結合后,招募核糖核酸內切酶RNAseH,對靶基因進行降解;與mRNA的起始翻譯位點結合,導致mRNA無法翻譯,從而無法編碼蛋白質;與miRNA結合抑制miRNA功能;與pre-mRNA結合,改變剪接體的剪接位置。
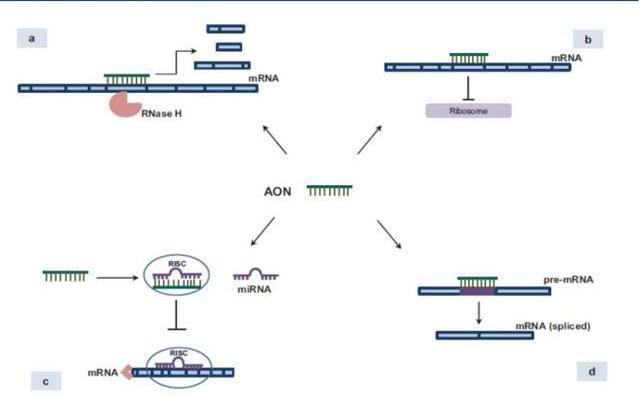
目前有八種反義核酸藥物已獲得監管機構的市場許可上市銷售。
Fomivirsen是由美國食品藥品監督管理局批準銷售的首個反義寡核苷酸藥物,由Inois和諾華合作研發,化學結構為具有硫代磷酸酯鍵的21位堿基的寡核苷酸。其藥效作用為與人巨細胞病視網膜炎IE基因的mRNA互補,抑制IE-2基因在CMV感染的細胞的表達,這是病復制所必需的基因。該藥物物在細胞培養中顯示出比篩選的其他多種硫代磷酸酯寡核苷酸更有效的抗CMV活性。隨后,由于高活性抗逆轉錄病療法的發展,CMV病例數急劇減少。諾華從2002年開始在歐洲和2006年在美國停止銷售該藥物。
聲音 | 南京中醫藥大學原副校長:中藥每一個產品開發的環節都是區塊鏈技術的記錄點:據中國質量新聞網報道,12月21日,首屆“中醫藥+區塊鏈”創新發展論壇在北京召開。中藥產業要實現升級,需要打破傳統,通過對“中醫藥+區塊鏈”技術和流通模式的研發及探索,實現基于區塊鏈技術的中藥溯源、防偽、供應鏈去繁瑣化、價值透明化等功能,從技術角度對傳統中醫藥流通生態增效、賦能。南京中醫藥大學原副校長段金廒認為,中藥資源可以在精細的設計下實現精準的開發利用,每一個產品開發的環節都是區塊鏈技術的記錄點。[2018/12/22]
Mipomersen,是治療純合子家族性高膽固醇血癥的第二代反義寡核苷酸藥物,藥理作用為抑制載脂蛋白B的合成。給藥方式為皮下注射,每周一次,注射200mg。Mipomersen具有明顯的血漿和組織末端消除半衰期,約為30天,每周一次給藥約4-6個月后即可達到穩態組織濃度。且其藥代動力學特性在所有研究的物種中通常保持一致。臨床試驗表明,Mipomersen無論是作為單一藥物還是在最大程度的降脂治療中,所有測得的含apoB的動脈粥樣硬化脂蛋白均呈劑量依賴性顯著降低。
Inotersen是2018年由FDA批準的第二代反義核酸藥物,用于治療遺傳性甲狀腺素介導的淀粉樣變性,藥效為通過RNaseH1依賴性機制阻止轉甲狀腺素蛋白的產生。TTR蛋白主要在肝臟中產生,形成與視網膜結合蛋白4-視網膜復合物結合的四聚體,防止其被腎臟清除,并用作幾種甲狀腺激素轉運蛋白之一。運甲狀腺素蛋白基因中的常染色體顯性突變導致蛋白質的四聚體形式變得不穩定。單體形成聚集體,沉積在包括周圍神經,心臟組織和腎臟在內的多個組織中。聚集物通常導致周圍神經病變,嚴重的胃腸道功能障礙,在某些情況下還引起心肌病。遺傳性TTR個體的平均預期壽命從癥狀發作開始通常為3-15年。實驗表明:Inotersen在培養的細胞和轉基因小鼠中產生劑量依賴性的TTRmRNA和蛋白質減少。在轉基因小鼠中,單劑量的inotersen產生的作用持續2至3周。施用Inotersen的食蟹猴也表現出肝臟中TTRRNA表達的減少90%,循環TTR蛋白減少80%。治療耐受性良好,未觀察到有害的肝腎功能。
Eteplirsen是2016年經FDA加速審批通過的ASO藥物,用于治療肌營養不良(DMD),藥理作用為旨在肌營養不良蛋白pre-mRNA的外顯子51結合并促進外顯子51的跳躍,而DMD患者在上游外顯子中具有選擇突變,略過外顯子51會產生截短但部分活性的肌營養不良蛋白產物,從而恢復一定的健康水平。臨床研究表明Eteplirsen通過肌肉內注射到短指伸肌短肌中后活檢組織中的肌營養不良蛋白表達有所增加,高劑量組的樣本中肌營養不良蛋白的表達高達正常肌營養不良蛋白表達的32%。
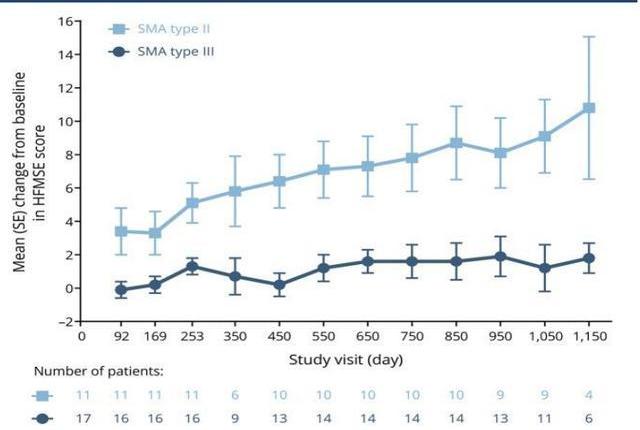
Nusinersen是用于治療脊髓性肌萎縮的ASO類藥物,長度為18個核苷酸。由于反義核酸藥物不能穿越完整的血腦屏障,因此該藥物通過腰椎穿刺髓鞘內注射給藥。藥理作用為和SMN2mRNA的內含子7結合促進外顯子7包涵體的劑量依賴性增加,臨床實驗中在表達人SMN2的轉基因小鼠中增加了SMN2蛋白含量。Nusinersen的初始臨床研究針對2型和3型SMA受試者,這可以評估在醫學上穩定的患者群體中髓鞘內注射藥物的安全性和耐受性。結果顯示:與自然情況相比,給藥后觀察到運動功能的改善和存活率的提高,以及藥物作用機理的生化證明。上市后2019年銷售額達19億美元,在商業上取得了成功,證明了ASO藥物的商業潛力。
Golodirsen也是用于治療肌營養不良的一種PMO修飾的ASO藥物,專門靶向肌營養不良蛋白pre-mRNA的外顯子53,從而將其從最終的mRNA產品中排除。在具有適當突變的DMD患者中,外顯子53的跳過導致mRNA閱讀框的恢復,并導致部分內部缺失的肌營養不良蛋白的C和N末端區域完整。大約7.7%的DMD患者具有突變,可以跳過第53外顯子來恢復其閱讀框架。研究表明,在接受Golodirsen治療48周后,與25個DMD男孩的基線測量值相比,肌營養不良蛋白的含量有統計學上的顯著增加,結果為相對于正常對照組肌營養不良蛋白的平均百分數為1.019%,并且平均熒光強度增加。通過免疫熒光定量的肌營養不良蛋白陽性肌纖維百分比也顯示了正確的肌膜定位。
Volanesorsen是2019年由EMA批準的第二代2′-MOE修飾反義核酸藥物。用于治療家族性高乳糜微粒血癥。它選擇性地結合在載脂蛋白apoC3mRNA的3'非翻譯區域內。這種結合可防止apoC3mRNA的翻譯,并允許核糖核酸酶H1介導的mRNA降解,從而通過LLP依賴性途徑促進甘油三酸酯清除并降低血漿甘油三酸酯水平。這些途徑包括apoC3抑制由LDLR和LRP1介導的肝受體介導的途徑。實驗結果顯示:Volanesorsen在人肝癌細胞系和原代人肝細胞中以濃度依賴的方式選擇性降低apoC3mRNA含量。施用Volanesorsen與血漿中apoC3蛋白的劑量依賴性降低和甘油三酯水平的平行降低呈現統計學相關。
周二科技及醫藥類公司新聞總結:INTL:英特爾下跌2.5%,報34.6美元。英特爾將于周三迎來歐洲反壟斷機構的裁決,裁定其是否提供非法回扣以排擠競爭對手。AMD/NVDA:AMD下跌2.1%,報12.9美元;英偉達下跌2.7%,報165.9美元。此前中國央行叫停ICO,導致比特幣價格暴跌,AMD和英偉達顯卡的挖礦需求或受到影響。WDC:西部數據下跌1%,報89.5美元。媒體報道稱,西部數據已經提出退出對東芝存儲芯片部門的競購,以加強在雙方合資企業中的地位。INSM:制藥公司Insmed上漲119.6%,報27美元。公司計劃申請加速其非結核分枝桿菌(NTM)肺部疾病治療藥物的審批,此前該藥物達成了晚期研究的主要目標,目前針對NTM還沒有被批準的治療藥物。CLLS:生物科技公司Cellectis下跌20.3%,報25.7美元。由于在試驗過程中一名患者死亡,公司目前正在研發的癌癥基因療法被迫暫停試驗。ORMP:制藥公司OramedPharmaceuticals上漲5.8%,報8.9美元。FDA推薦ORMP的口服胰島素申請生物制品許可證,一旦申請獲得通過,ORMP的口服胰島素[2017/9/6]
Casimersen是2021年剛由FDA批準的治療杜氏肌營養不良癥的ASO藥物。該藥利用Sarepta專有的磷酸二酰胺嗎啉代寡聚體化學和外顯子跳過技術,跳過DMD基因的第45號外顯子,允許產生一個內部截短的肌營養不良蛋白,從而治療51外顯子跳躍突變DMD患者(占DMD人群的13%)。臨床實驗結果顯示,通過蛋白免疫印跡檢測,Casimersen組患者在接受治療48周后,平均抗肌萎縮蛋白水平由基線的0.925%上升至1.736%。同時,AMONDYS45組患者的抗肌萎縮蛋白水平顯著高于安慰劑組。
Alicaforsen是由AtlanticHealthcare開發的用于治療慢性結腸袋炎的ASO藥物,處于III期臨床實驗。慢性結腸袋炎是在手術并發癥或潰瘍性結腸炎期間在結腸袋內層引起的炎癥。炎癥反應中ICAM-1可將循環中的白細胞引導至炎癥部位,并增加結腸袋炎的炎癥反應。而Alicaforsen可與ICAM-1mRNA雜交并降低其水平。在臨床試驗中,Alicaforsen治療可減少炎癥和大便次數,從而改善生活質量。內窺鏡檢查也顯示了下層組織的改善。
Tominersen是由IonisPharmaceuticals開發的用于治療亨廷頓病的ASO藥物,正處于臨床III期研究。亨廷頓病是一種常染色體顯性遺傳的進行性神經退行性疾病,病理表現為肌張力障礙,認知功能障礙和行為障礙。致病機理為相關基因CAG三核苷酸重復擴增導致亨廷頓蛋白質具有延伸的聚谷氨酰胺束,相關mHTT在神經元中積累最終會影響其正常功能。Tominersen可用于靶向mHTTmRNA以防止蛋白質產生。在46例早期HD患者中評估的I和II期臨床試驗中,證明了Tominersen具有改變疾病的潛力。患者接受鞘內注射三個月的每月劑量的Tominersen或安慰劑。以90和120mg的劑量在腦脊液中觀察到mHTT蛋白平均降低40%。該候選藥物在患者中顯示出良好的耐受性,并且在高劑量下無不良反應。
Tofersen是一種用于治療家族性肌萎縮性側索硬化癥的在研ASO藥物,處于臨床III期研究。超氧化物歧化酶酶在清除體內產生的自由基方面起著至關重要的作用。SOD1基因的突變導致功能異常的SOD1的產生,該SOD1以性蛋白的形式積累在細胞中,并導致家族性肌萎縮性側索硬化癥。而Tofersen可用于靶向突變的SOD1mRNA,以防止蛋白質產生,從而減慢ALS的進展。一項I和II期雙盲,隨機,安慰劑對照試驗顯示,Tofersen治療組的機能障礙性腦脊髓液SOD1濃度降低。與安慰劑對照相比,Tofersen治療還可以改善呼吸和肌肉功能。Tofersen由Biogen開發,目前正在進行III期試驗,以檢查Tofersen在SOD1-ALS患者中的臨床療效。
siRNA小干擾核酸類藥物
siRNA是一種長約21-23個堿基對的雙鏈RNA,在細胞核中轉錄后,雙鏈siRNA以及相關的蛋白質便會穿過核孔,并在核孔中由RNaseIII核酸酶裂解形成單鏈siRNA,導致在3'端的兩個核苷酸突出和在5'端的單磷酸突出。如此形成的單鏈siRNA與Ago等蛋白質結合,降解雙鏈siRNA的過客鏈并摻入引導鏈,此鏈用于和互補mRNA的識別,并作為切割的模板,形成的蛋白復合物稱為沉默效應復合物。基因沉默時,引導鏈保持附著于RISC,并將復合物引導至靶mRNA。在正確識別與引導RNA互補的mRNA核苷酸序列后,切割過程通過在引導RNA的5'一磷酸末端上游切割10至11個核苷酸的mRNA來實現。該過程借助酶Ago2催化,該酶是RISC的最重要組成部分之一。切割后的mRNA無法繼續完成原有的生物學功能,從而完成沉默。
阿里健康聯合天士力等十余家醫藥企業成立藥品全追溯聯盟:阿里健康今日宣布聯合天士力、廣藥集團、科倫藥業等十余家醫藥企業成立中國藥品安全追溯聯盟,以推動藥品行業形成共治的藥品安全追溯態勢,保障藥品從生產、到流通再到使用的全程安全。聯盟未來將聯合行業企業、技術服務公司、專家學者,在四個領域發力:建立探索建立藥品全程追溯平臺;建立消費者藥品安全服務標準,共同推動消費者提升安全用藥意識;探索區塊鏈技術在藥品追溯系統的應用;建立醫藥數據安全應用和管理規范。[2017/8/28]
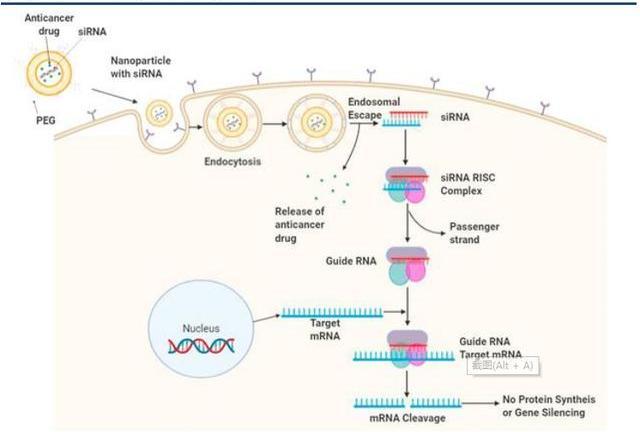
Patisiran是第一種由FDA批準的siRNA藥物。用于治療遺傳性ATTR淀粉樣變性病,經過2’MOE化學修飾,以脂質納米顆粒靶向遞送至肝細胞TTRmRNA。臨床I期研究顯示,在0.15、0.3和0.5mg/kg劑量的Patisiran靜脈內輸下,血漿TTR蛋白的濃度呈現劑量依賴性降低。輸注后約7天出現最大程度的減少,并且效果持續了一個多月。
Givosiran是2019年11月FDA批準的第二種siRNA藥物。由Alnylam研發,用于治療成人急性肝卟啉癥,皮下給藥且耐受性良好。與有義鏈結合的GalNAc促進了肝細胞的吸收。進入肝細胞后,它與氨基乙酰丙酸合酶1mRNA結合并使其沉默。
Lumasiran是一種皮下注射的siRNA藥物,由Alnylam公司開發,用于治療1型原發性高草酸尿癥。草酸是與PH1臨床表現直接相關的有代謝產物,Lumasiran的藥效原理為靶向羥酸氧化酶1基因,通過使編碼乙醇酸氧化酶的基因沉默,阻斷乙醇酸氧化酶的合成,從而抑制了草酸的合成。2020年11月19日,Lumasiran在歐盟獲得了首個全球批準,用于治療所有年齡段的PH1。2020年11月23日,Lumasiran在美國獲準用于治療患有PH1的成人和兒童。
Inclisiran是針對PCSK9蛋白的長效皮下遞送siRNA藥物,與GalNAc綴合遞送。GalNAc可與肝臟大量表達的去唾液酸糖蛋白受體結合,導致藥物特異性地被肝細胞攝取。Inclisiran通過硫代磷酸酯,2'-MOE和2'-F組合修飾,以提高分子穩定性。在涉及非人類靈長類動物的臨床前研究中,每公斤體重3mg以上的劑量可使血漿PCSK9水平降低80%以上,并使血清LDL膽固醇水平降低約60%,峰值作用持續超過30天后,在給藥后90到120天內非常緩慢地恢復到基線水平。這項1期研究評估了LCL膽固醇水平至少為100mg/dl的健康志愿者單次或多次皮下給予Inclisiran的安全性,副作用和藥效學作用少數參與者服用穩定劑量的他汀類藥物聯合療法。
QPI-1002是一種由QuarkPharmaceuticals研發的siRNA藥物,正處于III期臨床實驗,可抑制促凋亡蛋白p53的表達,主要用于預防初次心血管手術后的急性腎損傷,以及預防已故的供體腎移植后的延遲移植功能。AKI是一種臨床上壓倒性疾病,導致大約5%的住院人數,并且據記錄,在AKI術后30天內,死亡率超過50%。DGF也是腎移植后立即發生的最普遍的并發癥之一,影響了25%–40%的死者供腎移植患者。QPI-1002已被美國食品和藥物管理局和歐洲藥品管理局授予在腎臟移植中預防DGF的孤兒藥稱號。在2010年8月,夸克與諾華簽署了該藥物所有適應癥的獨家許可協議。
Fitusiran是AlnylamPharmaceuticals開發的用于治療血友病的siRNA的藥物,處于III期臨床實驗階段。血友病是由于凝血因子VIII或IX缺乏引起的X連鎖出血性疾病。而Fitusiran的作用是抑制肝臟中的抗血栓mRNA。在II期臨床試驗中,每月對25名A和B型血友病患者給予Fitusiran。實驗顯示,81%的ATmRNA敲低對應于出血頻率降低49-100%。用Fitusiran治療13個月后,患者的年化出血率從12提高到1.7。
Aptamer核酸適配體類藥物
核酸適配體是折疊成獨特的三維結構的短單鏈寡核苷酸。可利用其三維結構特異性結合較大范圍的目標,包括蛋白質,小分子,金屬離子,病,細菌和全細胞,其高特異性和結合親和力可達到抗體水平。與抗體相比,核酸適配體具有許多優勢,例如體外篩選快速,可無細胞化學合成,以及體積小,具有較低免疫原性和較強組織穿透力。
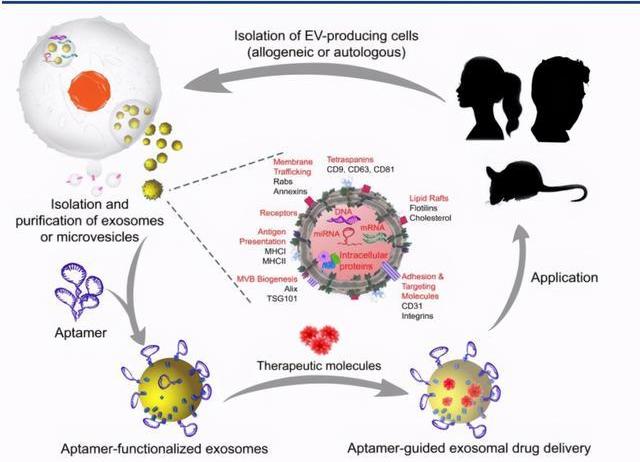
Aptamer的制備通常采用指數富集的配體選擇性進化技術。SELEX通常分為四個步驟:孵育,分配,回收和擴增。首先通過將初始DNA或RNA文庫與目標靶標混合而開始。一個文庫通常包含最多20–60個核苷酸的隨機序列。孵育后,靶標結合的序列通過各種分配策略與未結合的序列分離。回收結合靶標的序列后再擴增以產生用于隨后選擇循環的新文庫。新的DNA文庫可通過PCR直接擴增,而回收的RNA序列必須在PCR擴增之前逆轉錄為cDNA,并在下一個周期轉錄成新的RNA文庫。選擇循環重復2至15次后,可使用測序分析來鑒定已在文庫中富集的特定序列。為了增強目標結合序列的富集,還可以在選擇周期內通過操縱文庫與目標的比例來提高選擇嚴格性。
Pegaptanib是目前唯一獲批的Aptamer藥物。它是一種具有29個核苷酸的RNA適配體,5'末端包括一個40kD聚乙二醇部分,可延長組織停留時間。藥理作用為抑制血管內皮生長因子165,后者主要負責病理性眼部新血管形成和血管通透性,同時保留了同工型VEGF121的活性。經過十多年的發展和臨床前研究,Pegaptanib在臨床試驗中顯示可有效治療與年齡相關性黃斑變性相關的脈絡膜新生血管。在接受長達三年的治療的患者中也證實了其出色的眼部和全身安全性。對照良好的研究進一步表明,Pegaptanib在人血漿中穩定超過18h,而在猴子中,單次給藥后4周在玻璃體內檢測到Pegaptanib進入玻璃體。
目前還有諸多Aptamer產品處于臨床研究階段。
Zimura是聚乙二醇修飾的單鏈寡核苷酸Aptamer藥物,可靶向并抑制補體因子C5。而補體級聯反應中對C5的抑制可防止關鍵末端片段的形成。補體C5b-9參與MAC過程,通過細胞膜的破壞引起細胞死亡的形成。IIa期臨床試驗中對65例先前未曾使用抗血管內皮因子藥物的濕性AMD患者進行了玻璃體內聯合0.5mgRanibizumab施用Zimura的安全性研究。與接受Ranibizumab單抗單藥治療的患者相比,接受Ranibizumab單抗-Zimura聯合治療的患者視力得到改善的百分比更高。
REG1是一種由RegadoBiosciences開發的抗凝系統,目前處于II期臨床試驗中。包括RB006,凝血因子IXa特異性適體及其寡核苷酸解劑RB007。REG1目前正在通過臨床實驗評估為可逆性抗凝劑,用于經皮冠狀動脈介入治療。RB007是完全2'-O-甲基取代的17-mer寡核苷酸,其與RB006的5'-末端區域互補。而RB007則快速破壞RB006的結構并抑制其抗凝功能。臨床實驗顯示并靜脈內給藥后體內抗凝作用迅速開始,然后在服用RB007解劑78后迅速恢復至基線水平。
mRNA信使核酸類藥物
mRNA是機體內指導蛋白質合成的基礎性RNA分子,理論上外源mRNA可補充相關蛋白的含量,從而治療特定的疾病。這種概念可以追溯到1978年,當時的第一個嘗試是使用脂質體將兔珠蛋白mRNA遞送至小鼠淋巴細胞并產生功能性蛋白質。然而,在接下來的十年中,由于不穩定性,細胞滲透性差,免疫原性以及生產成本高等諸多問題,mRNA并未被用作治療劑。自1990年代以來,隨著核酸化學的研究的推進和mRNA生產成本的持續下降,mRNA被用作潛在的免疫治療劑。早期臨床試驗是用編碼腫瘤特異性抗原的mRNA轉染樹突狀細胞,以刺激細胞性T淋巴細胞抵抗癌癥,例如轉移性前列腺腫瘤。在過去的十年中,由于基于mRNA的治療方法具有以下優點,其應用已擴展到應對多種疾病和病癥:mRNA不會修飾宿主的基因,從而避免了基因性。可以以相對受控的方式遞送mRNA以調節轉染效率和蛋白質表達的持續時間。mRNA的傳遞不需要核定位或轉錄。另外,mRNA特別適合瞬時蛋白質表達,例如基因組編輯,以最大程度地減少脫靶效應。所有這些優點使得眾多藥企認為mRNA是一類潛在的新型治療劑,可用于治療遺傳性疾病,癌癥,傳染病,心血管疾病等病癥。mRNA療法主要包括:通過外源導入mRNA來糾正基因表達缺陷或異常;將表達抗原蛋白的mRNA制成疫苗。
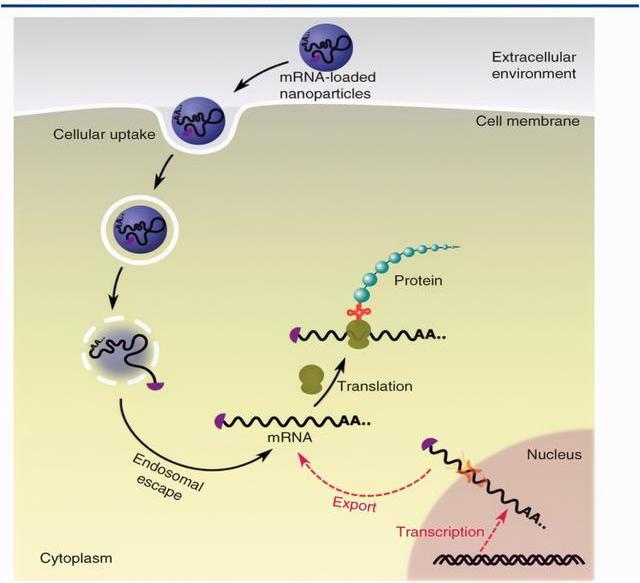
目前mRNA應用主要集中在疫苗領域,優勢體現在其設計速度快,低蛋白水平就可激發人體免疫反應。且一條mRNA可以聯合用藥編碼多個蛋白,成本較重組蛋白更低。
新冠肺炎疫情期間mRNA疫苗的研發與臨床實驗得到了全世界的關注,比較具有代表性的是Moderna公司的mRNA-1273疫苗。該疫苗是一種脂質納米顆粒包裹的,基于mRNA的疫苗,可編碼引起Covid-19疫情的SARS-CoV-2病的預融合穩定全長刺突蛋白,注射入人體后可引起相應的免疫反應。臨床實驗表明,mRNA-1273疫苗在預防Covid-19疾病方面顯示出94.1%的功效。除了短暫的局部和全身反應外,未發現安全隱患,藥效優秀。除了在疫苗領域的應用,還有一些外源mRNA補充蛋白療法處于臨床研究中。
BNT111是由BioNTech公司開發的mRNA藥物,處于I期臨床實驗,用于治療轉移性腫瘤患者的晚期黑色素瘤,并作為腫瘤切除后的輔助治療。它旨在引發對四種黑素瘤相關抗原的免疫反應。首次人體劑量遞增研究評估了晚期黑色素瘤患者結內給藥的安全性和耐受性,表明該藥物經過優化可誘導針對惡性黑色素瘤靶抗原的抗原特異性CD8+和CD4+T細胞應答。
CV8102是一種基于非編碼單鏈RNA的TLR7/8/RIG-1激動劑,旨在調節腫瘤內注射后的腫瘤微環境,并誘導全身免疫反應,以控制注射和未注射的遠處病變。目前正在對CV8102進行公開的I期臨床劑量遞增和擴大研究,其中包括晚期黑色素瘤,皮膚鱗狀細胞癌,頭頸部鱗狀細胞癌或腺樣囊性癌以及淺表可注射的腫瘤病變。
三、小核酸產業化步入新紀元,有望成為小分子與單抗之后第三大類藥物
政策持續鼓勵創新研發,小核酸藥物列入重點發展領域
基因治療與小核酸藥物列為政策重點扶持領域。國際層面,FDA相繼發布6大指南推進基因療法開發,包括血友病、視網膜疾病和罕見病的人類基因治療指南,以及3個基因療法的指南更新。目前FDA已經審批通過13個小核酸藥物上市,扶持力度可見一斑。國內層面,近年來我國大力鼓勵創新研發,優先審評審批、藥品上市許可人等重磅政策頻出,基因治療與小核酸藥物被列出重點扶持領域。
小核酸優勢明顯,適應癥范圍廣,應用潛力大
與小分子和單抗藥物相比,小核酸藥物具有明顯優勢。小核酸藥物通過上/下調靶基因的表達,從而實現疾病治療的目的,我們認為,小核酸藥物具有如下幾方面優勢。候選靶點豐富。小分子藥物與抗體類藥物靶點多為蛋白質,包括激酶、受體、抗原等,而人類疾病相關的致病蛋白約80%不能被目前常規的小分子藥物與生物大分子制劑所靶向,屬于不可成藥蛋白。同時,人類基因組中,只有1.5%的基因序列編碼蛋白質,和疾病相關的蛋白只占其中10-15%。而小核酸藥物作用于靶基因,因此能針對難以成藥的蛋白靶點實現突破,極大地擴展靶點的作用范圍。在小分子與抗體藥物不可靶向、難以成藥的疾病領域具有巨大的應用潛力。設計簡便。小核酸藥物的數字化設計使其早期研發速度遠遠快于其他種類藥物。不同于小分子藥物開發需要大規模化合物篩選,小核酸藥物只需要鎖定致病基因序列,并針對該基因序列進行設計及相應RNA片段的合成,繼而開展候選化合物篩選和驗證。強特異性。通過堿基互補配對以序列特異性的方式結合到靶基因mRNA,使得小核酸藥物具有精準、高效的效果。藥效持久。經穩定化修飾的小核酸藥物通過調控mRNA抑制相關蛋白的表達,療效持久,可實現更少的給藥頻次。在部分適應癥中,小核酸藥物已可實現半年一次的給藥頻率,大幅提高患者依從性,這一特點對很多疾病尤其是慢病的治療具有巨大的臨床價值。臨床開發成功率高。小核酸藥物通過測定基因序列鎖定疾病基因,針對性設計避免了研發過程的盲目性,在研發成功率上達到了突破性的變革,以Alnylam為例,其研發項目從Ⅰ期臨床進展到Ⅲ期臨床開發成功率達到59.2%,遠高于制藥行業平均5.5%的臨床開發成功率。
候選靶點豐富,適應癥范圍廣,應用潛力大。小核酸藥物從轉錄后水平治療,候選靶點豐富,特別針對一些蛋白靶點難以成藥的基因,未來適應癥范圍廣,應用潛力大。根據《RNAtherapeuticsontherise》,分析全球431個小核酸藥物在研項目,其中,63%處于pre-IND階段,32%處于早期臨床階段,3%處于Ⅲ期。研究項目覆蓋多個疾病治療領域,主要包括抗腫瘤、神經系統疾病、心腦血管、代謝疾病、傳染病、眼科疾病等。值得一提的是,小核酸療法在治療罕見病,尤其是神經系統和肝臟疾病方面取得了巨大成功。在21種處于研發后期的小核酸藥物中,18種為罕見病用藥。
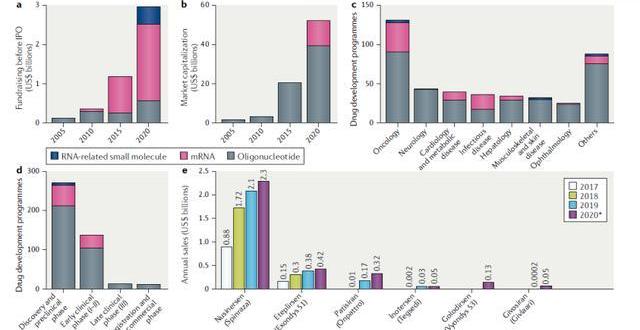
上市藥品銷售業績出色。產品端來看,獲批上市的小核酸藥物取得了出色的銷售業績。具代表性的是由Ionis公司研發的用于治療脊髓性肌萎縮癥(SMA)的藥物Nusinersen,上市后到2020年前該藥物總共產生了47億美元的銷售收入。此外由Alnylam研發的用于治療遺傳性轉甲狀腺素蛋白淀粉樣變性的藥物Patisiran在上市后第一年2019年也取得了1.5億美元的不錯銷售成績,預計2020年銷售額將翻一番。
小核酸藥物逐漸步入快速發展期,預計2024年全球市場規模超過80億美元。隨著化學修飾與遞送技術不斷突破,小核酸產業化瓶頸問題逐漸得以解決,行業步入快速發展期,2019年全球市場規模已達19.19億美元。根據EvaluatePharma和BCG分析,2024年全球小核酸市場規模將會達到86億美元,預計2018年-2024年CAGR將達到35%。
資本追捧,加快小核酸產業化進程
技術突破與新產品獲批為小核酸產業化注入極大信心,資本追捧加快小核酸產業化進程。
隨著核酸修飾和遞送技術的突破,曾經因技術瓶頸選擇退出的資本重拾信心入場。2019年,制藥巨頭羅氏斥資共16.7億美元獲得了治療慢性乙肝的藥物Dicerna的權益,該藥尚處I期臨床研究;輝瑞則以15.5億美元獲得了治療心血管和代謝性疾病的藥物Akcea的權益。2020年4月16日,mRNA藥物巨頭Moderna與美國生物醫學高級研究與開發局達成協議,將獲得最高4.83億美元的資金支持,擬用于測試和生產mRNA-1273疫苗;其曾以6.04億美元的募資創下了生物科技公司規模最大的IPO紀錄。資本巨頭黑石更是于20年4月斥巨資20億美元支持Alnylam的RNAi項目,成為biotech行業領域最大的單筆私有投資案例。
國內小核酸制藥領域經過不斷發展亦逐漸受到資本青睞。2020年國內小核酸制藥領軍企業瑞博生物獲得了4.7億元人民幣的C2輪融資支持,由中國國有資本風險投資基金領投,中金啟德基金、高瓴創投聯合領投,恒旭資本、朗瑪峰創投、上海自貿區基金和弘陶資本等知名投資機構共同跟投。本輪募集的資金擬用于支持瑞博生物在研品種的研發,促進其研發管線末端產品早日落地產生銷售收入。在此之前,公司先后獲得1.25億元的A輪融資、2.7億元的B輪融資和2.03億元的C1輪融資。目前,公司正在籌備科創板上市。
詳見報告原文。
精選報告來源:。
近日,據外媒消息報道,域名Poker.net以75萬美金的價格,被美國一家科技終端所收購,折合人民幣約488萬元。截至目前,這筆交易也創下了歷史記錄:史上最高的.net域名交易.
1900/1/1 0:00:00讀創/深圳商報記者苑偉斌近日,國家海洋局南海信息中心與深圳市海洋監測預報中心簽訂海洋信息化工作合作機制框架協議.
1900/1/1 0:00:00來源:IPFS原力區 據報道,2021年3月18日,由于Filecoin的遠程過程調用(RPC)代碼中的“嚴重錯誤”,出現了“雙花”問題。這些說法是不正確的,而且具有誤導性.
1900/1/1 0:00:00如今,比特幣迎來牛市,吸引了大批用戶入場,比特幣的交易費再度飆升。幣遇Bmeet合伙人王實據Bitinfocharts數據顯示,比特幣交易費平均在24至31美元之間.
1900/1/1 0:00:00在上周任天堂直面會一波爆發后,本周Switch這邊并沒有什么熱門新作。不過任天堂在本周為玩家準備了幾款“冷飯”,如果是這個系列的老玩家,估計已經準備好錢包準備買買買了吧.
1900/1/1 0:00:00比特幣800的時候我覺得很貴,等到它9000美金的時候我覺得不貴了,但卻沒有多余的資金去持有了.
1900/1/1 0:00:00